Lek psychotropowy w opakowaniu Atramu. Należy zwrócić go do apteki
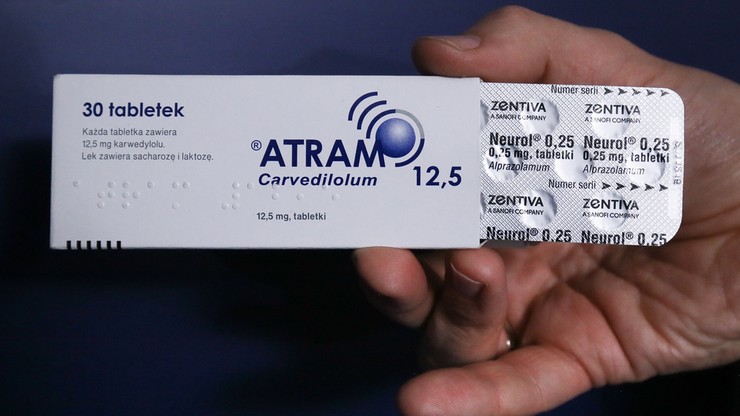
O wycofaniu leku poinformował we wtorek rzecznik Głównego Inspektoratu Farmaceutycznego Paweł Trzciński. Znaleziono dowody, że substancja ta została pomieszana z innym lekiem. Główny Inspektor Farmaceutyczny zdecydował także o wycofaniu z obrotu pojedynczych serii czterech innych leków wytwarzanych przez czeską firmę Zentiva, producenta Atramu.
Wycofane serie Atramu to: 2561215 i 2510216 (w obu przypadkach chodzi o tabletki Atram 12,5 mg) oraz serię 2010216 (tabletki Atram 6,25 mg). Daty ważności leków to listopad 2017 r. (seria 2561215) i styczeń 2018 r. (pozostałe dwie serie).
Decyzję podjęto w związku z zagrożeniem zdrowia publicznego wynikającym z pomieszania produktów leczniczych Neurol (lek psychotropowy) i Atram (lek kardiologiczny).
- Sprawa ta jest szczególnie ważna, z uwagi na to, że lek Atram jest lekiem kardiologicznym, który stosują pacjenci z chorobami nadciśnieniowymi, chorobami serca. Już samo to, że nie dostaną odpowiedniego leku, stanowi istotne zagrożenie dla ich zdrowia. Dodatkowo zażycie pomyłkowe leku psychotropowego może wpłynąć na ich stan zdrowia" - powiedział p.o. głównego inspektora farmaceutycznego Zbigniew Niewójt na konferencji prasowej we wtorek po południu.
"Na zasadzie chuchania na zimne"
Wieczorem GIF wycofał także leci: Simvacard 10 (10 mg tabletki powlekane, nr serii: 3010116, data ważności: grudzień 2018), Endiex (200 mg, kapsułki twarde, nr serii: 2020116, data ważności: grudzień 2017), Zoxon 2 (2 mg, tabletki, nr serii: 3510216, data ważności: styczeń 2019) oraz Chlorprothixen Zentiva (50 mg, tabletki powlekane, nr serii: 3600216, data ważności: styczeń 2019).
W decyzji napisano, że we wtorek GIF otrzymał ostrzeżenie (tzw. rapid alert) od swojego odpowiednika w Czechach w sprawie wycofania wspomnianych serii leków. "Decyzja została podjęta w związku z istniejącym ryzykiem pomieszania ww. produktów leczniczych" - napisano w uzasadnieniu.
Jak powiedział rzecznik GIF Paweł Trzciński, w ostrzeżeniu dotyczącym Atramu Czesi wspomnieli o tym, że istnieje prawdopodobieństwo, że mogło dojść do pomieszania Neurolu z jeszcze innymi lekami. Jednak w przeciwieństwie do Atramu nie ma na to twardych dowodów, a jedynie podejrzenie.
Dlatego - jak to ujął Trzciński - "na zasadzie chuchania na zimne" GIF zdecydował o wycofaniu pojedynczych serii Simvacardu 10, Endieksu, Zoxonu 2 i Chlorprothixenu Zentiva. Oznacza to, że te produkty muszą zostać wycofane z obrotu w hurtowniach i w aptekach i zostaną zniszczone. Decyzja GIF nie dotyczy pacjentów.
- To standardowa procedura, której używamy dosyć często. Ta, którą zastosowaliśmy w przypadku Atramu, czyli odbieranie leków od pacjentów, jest stosowana bardzo rzadko. Ostatnio zastosowaliśmy ją w przypadku corhydronu, czyli bardzo poważnego pomieszania sprzed 10 lat - wyjaśnił Trzciński.
Cztery leki wycofane
Simvacard to - jak informuje Urząd Rejestracji Produktów Leczniczych Wyrobów Medycznych i Produktów Biobójczych - lek stosowany w przypadku hipercholesterolemii (zwiększenie stężenia cholesterolu w osoczu), a także w celu zapobiegania zdarzeniom ze strony układu sercowo-naczyniowego.
Zoxon stosuje się w przypadku łagodnego rozrostu gruczołu krokowego oraz samoistnego nadciśnienia tętniczego.
Endiex to preparat wskazany w ostrej biegunce bakteryjnej.
Chlorprothixen Zentiva stosowany jest zaś w leczeniu psychoz endogennych i organicznych ze stanami pobudzenia ruchowego i agresywnością, niepokoju i bezsenności w nerwicach i zaburzeniach psychosomatycznych, psychoz alkoholowych. W chirurgii stosowany jest m.in. dla uspokojenia pacjenta oraz w celu zapobiegania wymiotom pooperacyjnym.
"Może dawać niepokojące objawy"
Wiceminister zdrowia Marek Tombarkiewicz wyjaśnił, że Neurol ma działanie nasenne i uspokajające. Dodał, że chodzi o najmniejszą dawkę leku, więc u osoby dorosłej, w pełni wydolnej zażycie pojedynczej dawki może nie stanowić żadnego zagrożenia, a pacjent może być tylko senny. Jednak w przypadku osób w podeszłym wieku, z niewydolnością wielonarządową, w tym niewydolnością nerek, zażycie Neurolu może być niebezpieczne. - Wtedy stosowanie przez jakiś czas takich leków może dawać jakieś niepokojące objawy związane z centralnym układem nerwowym - wiedział wiceszef MZ.
Tombarkiewicz zaznaczył, że bardziej obawiać się należy skutków niestosowania substancji zawartej w Atramie - carvedilolu - u osób, które powinny ją zażywać. Jak wyjaśnił, jest to dość popularny lek stosowany w nadciśnieniu tętniczym i niewydolności serca.
Mógł to być sabotaż zwolnionego pracownika
Niewójt powiedział, że we wtorek czeska agencja leków poinformowała GIF w procedurze rapid alert o tym, że w firmie Zentiva nastąpiło pomieszanie leków.
Poinformował także, że we wtorek spotkał się z polskim przedstawicielem producenta, firmą Sanofi-Aventis. Miała ona zadeklarować, że w środę wyda komunikat w sprawie trybu zwrotu, uzyskania rekompensaty lub wymiany leków.
GIF obecnie nie wie, ilu pacjentów może dotyczyć sprawa, ani od jak dawna wycofane serie były na rynku.
Niewójt, pytany o ewentualne wycofanie Neurolu, powiedział, że obecnie nie ma żadnych doniesień, które by wskazywały na taką konieczność. Dodał, że GIF cały czas jest w kontakcie ze swoim czeskim odpowiednikiem.
- Z niepotwierdzonych informacji wynika, że jest duże prawdopodobieństwo, że to był pewnego rodzaju sabotaż dokonany przez pracownika, który został z firmy zwolniony - powiedział Niewójt, pytany o przyczyny zamiany leków. Ocenił, że to najbardziej prawdopodobna ewentualność.
Substancje wstrzymane w obrocie
Jak powiedział Trzciński, obie substancje już wcześniej zostały wstrzymane w obrocie - od połowy sierpnia nie można było ich kupić. Podejrzewano, że produkty zostały pomieszane. Wykryła to kontrola GIF w jednej z hurtowni. Informacja ta została przekazana do Czech, gdzie lek jest produkowany. Czeski urząd uznał, że zagrożenie jest na tyle poważne, że rozesłał ostrzeżenie (tzw. rapid alert) do pozostałych krajów europejskich w związku z podejrzeniem wystąpienia niebezpiecznych dla zdrowia konsekwencji.
- Na początku wstrzymaliśmy obrót oboma lekami. Nie wiedzieliśmy, jak duże jest niebezpieczeństwo. Musieliśmy poczekać na informację od Czechów. Dowody na to, że rzeczywiście doszło do pomieszania, zostały znalezione tylko w Atramie - powiedział Trzciński.
GIF zdecydował, że określone serie Atramu zostaną wycofane z poziomu pacjenta. Oznacza to, że pacjenci są proszeni o zwrot określonych serii leku do aptek.
Atram jest wskazany w leczeniu nadciśnienia tętniczego samoistnego, przewlekłej, stabilnej dławicy piersiowej oraz wspomagającym umiarkowanej lub ciężkiej stabilnej, przewlekłej niewydolności serca. Podmiotem odpowiedzialnym w przypadku Atramu jest czeska spółka Zentiva, jej przedstawicielem w Polsce jest Sanofi-Aventis.
PAP
Czytaj więcej